- Tata Nama Senyawa Ionik
- Bilangan oksidasi logam dan non logam hanya 1
- Logam dan Non-logam + ida
- Misal: Natrium Iodida (NaI), Barium Klorida (BaCl2)
- Bilangan oksidasi lebih dari 1 (logam transisi)
- Logam - Bilangan Oksidasi - Non Logam + ida
- Misal: FeCl3 - Besi (III) Klorida
- Perlu diperhatikan bilangan oksidasi harus ditulis dengan angka romawi.
- Tata Nama Senyawa Kovalen
- Kedua nonlogam membentuk hanya 1 senyawa
- Non logam 1 + Non logam 2 + ida
- Misal: HI (Hidrogen iodida), HBr (Hidrogen bromida)
- Kedua nonlogam dapat membentuk lebih dari satu senyawa
- Awalan (mono, di, tri, dst.) + nama nonlogam 1 + Awalan + nama nonlogam 2 + ida
- Misal: CO (Karbon Monoksida), CO2 (Karbon Dioksida)
- Tata Nama Senyawa Poliatomik
Tata nama senyawa poliatomik ditentukan dengan nama kation + nama anion. Nama kation dan anion ditentukan melalui tabel ion poliatomik (harus dihafal! hehe)
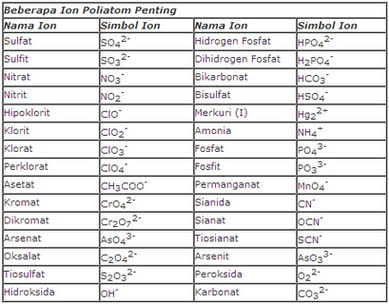
sumber: media belajar online
- Tata Nama Senyawa Organik
- Kalian akan belajar lebih lanjut tentang penamaan senyawa organik dalam topik Kimia Organik, karena senyawa organik jauh lebih kompleks dan lebih banyak variasi dibandingkan tata nama senyawa anorganik.
- Tata Nama Senyawa Asam Basa
- Asam
- Hidrogen berperan sebagai kation dari asam (H+). Maka, dalam penamaan asam, kata "asam" harus ditaruh paling depan sebelum nama anion.
- Basa
- Ion hidroksil (OH-) berperan sebagai anion dalam senyawa basa. Semakin banyak konsentrasi OH-, semakin basa suatu unsur tersebut. Maka, dalam penamaan basa, kata "hidroksida" harus ditaruh paling akhir, setelah nama kation dari senyawa tersebut.